RESUMO
Racional: O tratamento do câncer gástrico avançado com intenção curativa é essencialmente cirúrgico e a quimiorradioterapia está indicada como neo ou adjuvância para controlar a doença e prolongar a sobrevida.
Objetivos: Avaliar a sobrevida dos doentes submetidos à gastrectomia subtotal ou total com linfadenectomia D2 seguidos de quimiorradioterapia adjuvante.
Métodos: Foram analisados retrospectivamente 87 gastrectomizados portadores de adenocarcinoma gástrico avançado considerandos estádios IB até IIIC e submetidos à quimiorradioterapia adjuvante (protocolo INT 0116). Foram excluídos os tumores da transição esofagogástrica, com implantes peritoneais, metástases à distância e os que após a operação apresentaram margem cirúrgica comprometida ou óbito precoce. Foram separados quanto à extensão da gastrectomia e analisados em relação ao local e histopatologia do tumor, invasão linfonodal, estadiamento, morbidade e sobrevida.
Resultados: O número de doentes que conseguiu completar o esquema adjuvante na sua totalidade foi de 45 (51,7%). Os que iniciaram o tratamento e interromperam por toxicidade, piora relacionada ao tumor, ou perda de seguimento foram 10 (11,5%) e relacionados como adjuvância incompleta. O número de doentes que recusou ou não iniciou o tratamento adjuvante foi de 33 (48,3%). A gastrectomia subtotal foi indicada em 60 (68,9%) e a total em 27 (31,1%) e esta apresentou menor sobrevida. A média de linfonodos ressecados foi de 30,8. O estadiamento e o número de linfonodos acometidos foram preditores de pior sobrevida e quanto mais avançado foi o tumor. Os pacientes submetidos à terapia adjuvante com quimiorradioterapia completa mostraram sobrevida maior quando comparados àqueles que a fizeram de forma incompleta ou submetidos à operação exclusiva. Por outro lado, comparando-se os doentes estádios T4b (IIIB + IIIC) que tiveram adjuvância completa com os submetidos à operação exclusiva ou que não completaram a adjuvância, houve significativa diferença na sobrevida.
Conclusão - A quimiorradioterapia adjuvante apresenta ganho de sobrevida para doentes em estádio T4b submetidos ao tratamento cirúrgico com intenção curativa.
DESCRITORES: Neoplasias gástricas; Terapias adjuvantes; Gastrectomia
ABSTRACT
Background: The treatment of advanced gastric cancer with curative intent is essentially surgical and chemoradiotherapy is indicated as neo or adjuvant to control the disease and prolong survival.
Aim: To assess the survival of patients undergoing subtotal or total gastrectomy with D2 lymphadenectomy followed by adjuvant chemoradiotherapy.
Methods: Were retrospectively analyzed 87 gastrectomized patients with advanced gastric adenocarcinoma, considered stages IB to IIIC and submitted to adjuvant chemoradiotherapy (protocol INT 0116). Tumors of the esophagogastric junction, with peritoneal implants, distant metastases, and those that had a compromised surgical margin or early death after surgery were excluded. They were separated according to the extention of the gastrectomy and analyzed for tumor site and histopathology, lymph node invasion, staging, morbidity and survival.
Results: The total number of patients who successfully completed the adjuvant treatment was 45 (51.7%). Those who started treatment and discontinued due to toxicity, tumor-related worsening, or loss of follow-up were 10 (11.5%) and reported as incomplete adjuvant. The number of patients who refused or did not start adjuvant treatment was 33 (48.3%). Subtotal gastrectomy was indicated in 60 (68.9%) and total in 27 (31.1%) and this had a shorter survival. The mean resected lymph nodes was 30.8. Staging and number of lymph nodes affected were predictors of worse survival and the more advanced the tumor. Patients undergoing adjuvant therapy with complete chemoradiotherapy showed a longer survival when compared to those who did it incompletely or underwent exclusive surgery. On the other hand, comparing the T4b (IIIB + IIIC) staging patients who had complete adjuvance with those who underwent the exclusive operation or who did not complete the adjuvant, there was a significant difference in survival.
Conclusion: Adjuvant chemoradiotherapy presents survival gain for T4b patients undergoing surgical treatment with curative intent.
HEADINGS: Gastric neoplasm; Adjuvant therapy; Gastrectomy
INTRODUÇÃO
Apesar do declínio da incidência no resto do mundo, o câncer de estômago aparece em terceiro lugar na incidência entre homens e em quinto entre as mulheres no Brasil. Devido à agressividade da doença e os sintomas serem inespecíficos, a maioria já se apresenta com tumores avançados na ocasião do diagnóstico, proporcionando taxas de sobrevida baixas7,13,34.
O tratamento com intenção curativa mais efetivo para o câncer gástrico é o cirúrgico25. Devido às altas taxas de recorrência e prognóstico reservado, nos últimos 30 anos tem havido grande empenho por parte da comunidade médica para o desenvolvimento de terapias oncológicas efetivas - como quimioterapia e radioterapia, neoadjuvantes ou adjuvantes - no sentido de melhorar o prognóstico e a sobrevida em longo prazo. Portanto, o tratamento desse tumor deve ser multidisciplinar e individualizado8,15,19,26,40.
O tratamento cirúrgico, na maioria das vezes, é a primeira opção, e mesmo quando durante a operação não exista evidência de doença residual, na maioria dos casos há necessidade da complementação com alguma modalidade terapêutica adjuvante8. A invasão linfonodal, tipo histológico, lavado peritoneal positivo e local dos tumores são alguns dos importantes fatores prognósticos de sobrevida31.
Em 2001 foi publicado o ensaio clínico Intergroup-0116 (INT 0116), também conhecido como protocolo de MacDonald, que comparou dois grupos de doentes randomizados, tratamento cirúrgico seguido de quimioradioterapia pós-operatória vs. tratamento cirúrgico exclusivo. A quimioterapia preconizada foi utilizando 5-fluorouracil, leucovorin e a radioterapia foi indicada na dose total de 4500 cGy21. O esquema adjuvante mostrou resultados favoráveis e foi rapidamente incorporado como tratamento do câncer gástrico nos Estados Unidos e outros países do ocidente e oriente17,20,23,30,41. Entretanto, apenas 10% dos pacientes realizaram linfadenectomia D221. Assim, a literatura carece de estudos que avaliam o protocolo de MacDonald et al.21 na população de doentes submetidos à linfadenectomia D2, habitualmente empregado por alguns serviços de oncologia na população brasileira.
O objetivo desse estudo foi analisar retrospectivamente a morbimortalidade e a sobrevida dos portadores de câncer gástrico submetidos à gastrectomia subtotal ou total com linfadenectomia D2 e que realizaram a terapia adjuvante.
MÉTODOS
Foram selecionados prontuários de pacientes com diagnóstico prévio de adenocarcinoma gástrico avançado (não da cárdia) submetidos ao tratamento cirúrgico com intenção curativa, tratados e seguidos no Hospital das Clínicas da Universidade Estadual de Campinas, Campinas, SP, Brasil, entre janeiro de 2002 a agosto de 2013 e que utilizaram o protocolo de MacDonald et al. 21 no pós-operatório.
O tratamento oncológico adjuvante foi iniciado em média 45 dias após o tratamento cirúrgico e consistiu em 425 mg/m2 de 5-fluorouracil associado a 20 mg/m2 de leucovorin por cinco dias, seguido de radioterapia 180 cGy/dia por cinco dias durante cinco semanas. O período da radioterapia foi realizado entre o terceiro e o quarto ciclo da quimioterapia. A dose de 5-fluorouracil foi modificada para 400 mg/m2 e aplicada nos primeiros quatro dias e últimos três dias de radioterapia.
Foram identificados 127 casos com estádio IB até IIIC (TNM)3. No entanto, foram excluídos os que apresentavam margem de ressecção comprometida (n=15, 11,8%), metástases à distância (n=12, 9,4%), implantes peritoneais (n=8, 6,2%) e aqueles com óbito até 30 dias (n=5, 3,9%). O número final incluído nesta casuística foi de 87.
Além da análise de morbidade e mortalidade, foram também obtidas informações sobre perfil epidemiológico (idade e gênero), localização e histopatologia do tumor, número de linfonodos ressecados e acometidos, invasão angiolinfática e perineural, e tipo de procedimento realizado.
Análise estatística
Foram feitas tabelas de frequência das variáveis categóricas com valores de frequência absoluta (n) e percentual (%), e estatísticas descritivas das variáveis numéricas. No estudo dos fatores relacionados à sobrevida foi utilizada a análise de regressão de Cox. Para análise de sobrevivência foram construídas as curvas de Kaplan-Meier. O nível de significância adotado foi de 5%. Para análise estatística foram utilizados os seguintes programas computacionais: The SAS System for Windows (Statistical Analysis System), versão 9.4. SAS Institute Inc, 2002-2008, Cary, NC, USA9.
RESULTADOS
Os resultados estão resumidos nas Tabelas 1 e 2. Dependendo do local do tumor, foram realizadas a gastrectomia subtotal (n=60, 68,9%) ou total (n=27, 31,1%), e linfadenectomia a D2, seguindo protocolo da Associação Japonesa de Câncer Gástrico18,19. A localização tumoral predominante foi no antro (n=41, 47,1%) o que favoreceu a preferência pela ressecção subtotal. A média de linfonodos ressecados foi de 30,8 por doente, e foi considerada adequada18,19. Todos foram operados na mesma instituição pela mesma equipe de cirurgiões.
Gênero, faixa etária, procedimentos realizados, localização do tumor e complicações pós-operatórias (n=87)
A maioria estava com tumores no estágio mais avançado da doença - IIIA (n=17, 19,5%), IIIB (n=20, 22,9%) e IIIC (n=23; 26,4%) - totalizando 68,9% da casuística, refletindo o diagnóstico tardio. O tipo histopatológico mais frequente foi o adenocarcinoma moderadamente diferenciado (46%). Além disso, 32,1% apresentaram tanto invasão angiolinfática como perineural (Tabela 2). A Figura 1 mostra a sobrevida global dos 87 doentes analisados.
O risco de óbito comparando a gastrectomia total com a subtotal foi estatisticamente significante (HR=3,36 IC 95%=1,77-6,40, p=0,0002, Figura 2). Pior desfecho também ocorreu para aqueles com estadiamento avançado e maior acometimento linfonodal.
Sobrevida dos casos submetidos à gastrectomia subtotal (n=60) vs. gastrectomia total (n=27)
O número de doentes que conseguiu completar o esquema adjuvante na sua totalidade foi de 45 (51,7%). Os que iniciaram o esquema, mas interromperam por toxicidade, piora relacionada ao tumor, ou perda de seguimento foram 10 (11,5%), e foram considerados como adjuvância incompleta. O número de doentes que recusou ou não iniciou o tratamento adjuvante, foi de 33 (48,3%).
Os doentes submetidos à terapia adjuvante com quimiorradioterapia completa mostraram sobrevida maior pela curva de Kaplan-Meier quando comparados àqueles com terapia incompleta ou submetidos à operação exclusiva; entretanto, o resultado não foi estatisticamente significativo (HR=2,09, IC 95%=1,09-4,02, p=0,071, Figura 3). Por outro lado, comparando-se os doentes estádios T4b (IIIB + IIIC) que tiveram adjuvância completa com os submetidos à operação exclusiva também T4b, houve diferença estatística significativa na sobrevida (p=0,004, Figura 4). O estudo do grupo que realizou adjuvância incompleta foi prejudicado pelo número reduzido de pacientes.
Sobrevida dos três grupos estudados: tratamento adjuvante completo (n=43), tratamento adjuvante incompleto (n=10) e somente tratamento cirúrgico (n=34)
Sobrevida comparada dos doentes estádio T4b (IIIB + IIIC) submetidos à adjuvância vs. operação exclusiva (p=0,004)
Após o término do tratamento adjuvante, os pacientes foram acompanhados ambulatorialmente com consultas frequentes. Após dois anos as visitas eram semestrais. Todos realizaram seguimento clínico com a realização de ultrassonografia de abdome, endoscopia digestiva alta e tomografia computadorizada de abdome, pelve e tórax11.
O principal local de recidiva foi o peritônio (n=12, 13,7%) e fígado (n=10, 11,4%). A presença de recorrência tumoral foi preditora de piora na sobrevida (HR=2,28, IC 95%=1,08-4.81, p=0,029). Comparando o estadiamento III com os estadiamentos IB + IIA, verificou-se que o estadiamento III mostrou sobrevida estatisticamente menor (RR=2,49 IC 95%=1,1163-5,339, p=0,018). O número de linfonodos acometidos, também foi preditor de mau prognóstico (HR=1,174, IC 95%=0,465-2,956, p=0,028) nos casos estádio III. As demais comparações não mostraram diferença estatisticamente significante.
DISCUSSÃO
As estatísticas da Globocan mostraram que o câncer gástrico continua sendo importante em todo o mundo e responsável por mais de 1.000.000 de novos casos em 2018 e 783.000 mortes estimadas (o que equivale a 1 em cada 12 mortes globalmente). Tornou-se o quinto mais frequentemente diagnosticado e a terceira principal causa de morte por câncer. O tipo histológico mais frequente é o adenocarcinoma. Entre os homens, é o tumor mais comumente diagnosticado e a principal causa de morte por câncer em vários países da Ásia Ocidental6.
A ressecção cirúrgica, seguida da linfadenectomia adequada e análise detalhada dos linfonodos ressecados, continua a ser a melhor chance de controle da doença e de cura nos casos precoces. Apesar das melhorias nas técnicas cirúrgicas e da linfadenectomia mais extensa, 40-60% dos pacientes apresentam recidiva da doença entre 2-5 anos. Portanto, mesmo praticando-se ressecção cirúrgica R0, há melhora com a adição da quimioterapia e radioterapia, necessárias e indispensáveis para aumento da sobrevida14,31.
Recentemente, a terapia de conversão surgiu como alternativa, prolongando a sobrevida em doentes com doença neoplásica avançada. Consiste na administração de tratamentos oncológicos seguidos de tratamento cirúrgico em pacientes em estágio IV. É opção para tratar lesões irressecáveis ou não ressecáveis em doentes com metástase linfonodal distante e mesmo com doença metastática ou disseminação peritoneal32.
Apesar de grandes debates nos últimos 30 anos em relação sobre qual seria a melhor técnica cirúrgica e extensão da linfadenectomia, é atualmente aceito que a ressecção a D2 é a que traz melhores resultados em longo prazo em relação à sobrevida e recorrência do tumor. A maioria dos grandes ensaios clínicos recentes realiza a linfadenectomia a D2 como base da operação com intenção curativa22,27,36. É também consenso que a presença de margens microscopicamente acometidas é fator independente de prognóstico39.
Os tratamentos oncológicos, neoadjuvante, perioperatório ou adjuvante variam consideravelmente e os especialistas empregam vários esquemas, para controle efetivo da doença. Atualmente não há consenso sobre qual é o mais adequado, tendo em vista que os estudos realizados foram delineados de maneira heterogênea, com diferentes esquemas de diferentes drogas e doses, incluindo quimioterapia somente ou em associação com a radioterapia15,19,26,40.
Os estudos mais importantes incluindo tratamento quimioterápico neoadjuvante seguidos de procedimento cirúrgico, bem controlados e com longo seguimento foram MAGIC10, FFCD 970342 e FLOT-41. Interessante que a maioria dos estudos de tratamento quimioterápico adjuvante exclusivo são de origem asiática e incluem ACTS-GC33, CLASSIC24, SAMIT38 e ITACA-S5.Para reduzir a probabilidade de recorrência local do câncer gástrico ressecado, além da quimioterapia adjuvante, têm sido investigados tanto nos contextos neoadjuvantes como adjuvantes, os tratamentos locais empregando a radioterapia. Assim, os estudos que melhor avaliaram esse tratamento foram INT 011621, ARTIST28, POET37 e CROSS16. O estudo INT 0116 consagrou o tratamento pós-operatório com quimiorradioterapia utilizando 5- fluorouracil, leucovorin e a dose total de 4500 cGy e procurou mostrar o benefício do esquema para pacientes que se enquadravam do estágio T2N0 em diante, que segundo a classificação da época, incluía tumores que envolviam a subserosa e muscular própria, respectivamente (classificados como T3 e T2 na classificação atual TNM 2010). Este estudo demonstrou taxa de sobrevida de três anos de 50% no grupo que recebeu quimiorradioterapia vs. 41% no tratado com operação exclusiva (p=0.005), e taxa de sobrevida livre de progressão de 48% no grupo que recebeu quimiorradioterapia vs. 31% no tratado com operação exclusiva (p<0.001)21. Smalley et al.35 em 2012 também demonstraram que o benefício da associação da quimiorradioterapia permaneceu após 10 anos de seguimento pós-operatório e que os resultados permaneciam favoráveis em relação aos índices de mortalidade e recorrência tumoral.
Nesta pesquisa foram selecionados e incluídos os pacientes a partir do estágio T2N0 (IB) e aqueles com qualquer envolvimento linfonodal, de maneira a fazer seleção semelhante ao do artigo original sem incluir tumores da transição esofagogástrica. Foram incluídos 87 pacientes com seguimento completo de cinco anos; entretanto, apenas 49,1% completaram todo o tratamento, 11,5% iniciaram o tratamento e interromperam sem finalizar por efeitos colaterais severos e 39,1% não iniciaram o esquema terapêutico por falta de condições clínicas. A análise estatística não conseguiu demonstrar benefício em relação ao ganho de sobrevida para os pacientes submetidos ao tratamento adjuvante completo, considerando todos os estádios, embora a curva de Kaplan-Meier deste grupo tenha demonstrado diferença na média de sobrevida ao comparar os pacientes que realizaram adjuvância com os que não a realizaram (73,26 vs. 38,58 meses, respectivamente, Figura 3). É possível que com casuística maior o benefício da terapia adjuvante possa ser estatisticamente significante. Por outro lado, ao se comparar apenas os doentes estádios T4b (IIIB +IIIC) que realizaram ou não o tratamento adjuvante, foi demonstrado ganho de sobrevida (Figura 4). Nossos resultados também mostraram ganho estatisticamente significativo de sobrevida dos pacientes submetidos à gastrectomia subtotal quando comparados à total (Figura 2). Portanto, conforme já demonstrado na literatura, há importante aumento de morbidade quando comparados os resultados da gastrectomia total com a gastrectomia subtotal. Sempre que possível, é preferível a realização da ressecção gástrica subtotal, desde que as margens cirúrgicas sejam preservadas4,27.
Além disso, os doentes nos estádios I e II quando comparados ao estádio III, que não apresentaram recidiva tumoral no peritônio e fígado quando comparados aos que tiveram esse tipo de recidiva, e os doentes no estádio III que não apresentaram linfonodos acometidos quando comparados aos que tiveram acometimento linfonodal, também tiveram ganho de sobrevida. As outras comparações não evidenciaram diferenças estatisticamente significantes.
Uma das críticas relacionadas ao estudo de MacDonald et al.21 foi que apenas 10% dos pacientes (n=556) foram submetidos a ressecção D237. Esse fato suscitou dúvidas em relação a real necessidade da radioterapia para aqueles submetidos à ressecção radical. Outro aspecto negativo é a sua toxicidade; a hematológica pode atingir 54%, a gastrointestinal 33% e mortalidade relacionada ao tratamento 1%17.
Estudos semelhantes, utilizando o mesmo protocolo de adjuvância registraram resultados satisfatórios. Kim et al.20 empregaram esse protocolo em 544 doentes com tratamento considerado curativo e linfadenectomia D2, concluindo que taxas de sobrevida em cinco anos foram consistentemente mais longas nos estadios II, IIIA, IIIB e IV do que no grupo de 446 doentes submetidos à operação exclusiva. Além disso, a adjuvância empregada foi associada com aumentos na duração mediana da sobrevida livre de recidiva. Yakir et al.41 empregaram o mesmo protocolo em 36 doentes estádio T4b, concluindo que a mediana da sobrevida livre de doença foi de 37,4 meses e sobrevida global de 40,3 meses, sem nenhum óbito relacionado à toxicidade do tratamento. Montenegro et al.23 utilizaram o mesmo protocolo em 84 doentes com adenocarcinoma gástrico avançado submetidos à ressecção gástrica e linfadenectomia D2, concluindo que a média de sobrevida em três anos foi de 23,9%; entretanto, analisando os grupos por invasão linfonodal, constataram que no mesmo período a sobrevida em N1 foi de 100%, N2 de 51.9% e N3 de 16.3%. Concluíram que o protocolo de adjuvância utilizado reduziu o risco de morte e recidiva para três anos, principalmente em pacientes com linfonodos N1-N2 positivos submetidos à ressecção curativa com linfadenectomia D2; mas, a recorrência foi mais frequente em linfonodos N3 positivos e sugerem empregar novos protocolos de adjuvância nesse grupo para diminuir as taxas de recidiva. Peng et al.30 compararam dois grupos de doentes IIIC submetidos à ressecção gástrica e linfadenectomia D2, seguidos de adjuvância associando quimiorradioterapia (n=33) e apenas quimioterapia (n=57) concluindo que a quimiorradioterapia foi bem tolerada e elevou a sobrevida livre de doença. Favacho et al.12 analisaram 27 doentes com câncer gástrico avançado estádio T4b, apenas submetidos ao tratamento cirúrgico sem terapia adjuvante e relataram sobrevida em seis meses de 63,27%.
Ao nosso entender, para melhor avaliação sobre a resposta do tratamento quimiorradioterápico adjuvante é importante eliminar fatores que possam modificar ou criar vieses prognósticos na casuística selecionada. As dosagens de biomarcadores como HER2, instabilidade microsatélite, o vírus Epstein-Barr, a dosagem de PD-L1 e outros, poderão contribuir para abrir novos tratamentos os quais associados à quimiorradioterapia poderão contribuir para aumento de sobrevida29.
Portanto, deve ser enfatizado que o tratamento do câncer gástrico é obrigatoriamente multidisciplinar2,15, e a análise da sobrevida desta casuística sugere que o esquema de quimiorradioterapia proposto por MacDonald et al.21 apresenta benefícios para pacientes com doença avançada submetidos ao procedimento cirúrgico com intenção curativa e linfadenectomia D2. São necessários estudos adicionais com desenho semelhante e maior casuística para definir o real benefício da quimiorradioterapia adjuvante no tratamento do câncer gástrico avançado.
CONCLUSÃO
A quimiorradioterapia adjuvante apresenta ganho de sobrevida para doentes em estádio T4b submetidos ao tratamento cirúrgico com intenção curativa.
Referências bibliográficas
-
1 Al-Batran SE, Homann N, Pauligk C, Goetze TO, Meiler J, Kasper S, Kopp HG, Mayer F, Haag GM, Luley K, Lindig U, Schmiegel W, Pohl M, Stoehlmacher J, Folprecht G, Probst S, Prasnikar N, Fischbach W, Mahlberg R, Trojan J, Koenigsmann M, Martens UM, Thuss-Patience P, Egger M, Block A, Heinemann V, Illerhaus G, Moehler M, Schenk M, Kullmann F, Behringer DM, Heike M, Pink D, Teschendorf C, Löhr C, Bernhard H, Schuch G, Rethwisch V, von Weikersthal LF, Hartmann JT, Kneba M, Daum S, Schulmann K, Weniger J, Belle S, Gaiser T, Oduncu FS, Güntner M, Hozaeel W, Reichart A, Jäger E, Kraus T, Mönig S, Bechstein WO, Schuler M, Schmalenberg H, Hofheinz RD; FLOT4-AIO Investigators. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial. Lancet. 2019;393(10184):1948-1957 - doi: 10.1016/S0140-6736(18)32557-1
» https://doi.org/10.1016/S0140-6736(18)32557-1 -
2 Alves LB, Tsukazan MT, Serafim AE, Mendoza R, Padoin AV, Baú PC, Moreira LF. Prognostic value of carcinoembryonic antigen levels in transoperative peritoneal lavage in patients with gastric cancer. Arq Bras Cir Dig. 2018;31(1):e1358 - doi: 10.1590/0102-672020180001e1358.
» https://doi.org/10.1590/0102-672020180001e1358 - 3 American Joint Committee on Cancer Staging Manual, 7th, Edge SB, Byrd DR, Compton CC, et al (Eds), Springer, New York 2010. p.117.
-
4 Andreollo NA, Lopes LR, Coelho Neto JS. Postoperative complications after total gastrectomy in the gastric cancer. Analysis of 300 patients. ABCD Arq Bras Cir Dig. 2011;24(2):126-130 - doi:10.1590/S0102-67202011000200007.
» https://doi.org/10.1590/S0102-67202011000200007 -
5 Bajetta E, Floriani I, Di Bartolomeo M, et al. Randomized trial on adjuvant treatment with FOLFIRI followed by docetaxel and cisplatin versus 5-fluorouracil and folinic acid for radically resected gastric cancer. Ann Oncol. 2014;25(7):1373-1378. - doi:10.1093/annonc/mdu146
» https://doi.org/10.1093/annonc/mdu146 - 6 Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394-424. - doi: 10.3322/caac.21492
-
7 Brazil, Ministry of Health National Cancer Institute. [database on the Internet]. In 2018. Available from: https://www.inca.gov.br/tipos-de-cancer/cancer-de-estomago
» https://www.inca.gov.br/tipos-de-cancer/cancer-de-estomago -
8 Choi YY, Noh SH, Cheong JH. Evolution of Gastric Cancer Treatment: From the Golden Age of Surgery to an Era of Precision Medicine. Yonsei Med J. 2015;56(5):1177-1185.- doi: 10.3349/ymj.2015.56.5.1177.
» https://doi.org/10.3349/ymj.2015.56.5.1177 - 9 Collett, D. Modelling Survival Data in Medical Research, Chapman & Hall, London, 1994.
-
10 Cunningham D, Allum WH, Stenning SP, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med. 2006;355(1):11-20.- DOI:10.1056/NEJMoa055531
» https://doi.org/10.1056/NEJMoa055531 -
11 Eom BW, Ryu KW, Lee JH, Choi IJ, Kook MC, Cho SJ, Lee JY, Kim CG, Park SR, Lee JS, Kim YW. Oncologic effectiveness of regular follow-up to detect recurrence after curative resection of gastric cancer. Ann Surg Oncol. 2011;18(2):358.- DOI:10.1056/NEJMoa055531
» https://doi.org/10.1056/NEJMoa055531 - 12 Favacho BC, Costa Cda S, Magalhães TC, de Assumpção PP, Ishak G. T4b gastric carcinoma: 12 years of experience at an University Hospital. Arq Bras Cir Dig. 2013;26(4):268-73.- dói: 10.1590/S0102-67202013000400004.
-
13 Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136: E359-86.- doi: 10.1002/ijc.29210.
» https://doi.org/10.1002/ijc.29210 -
14 Giampieri R, Del Prete M, Cantini L, Baleani MG, Bittoni A, Maccaroni E, Berardi R. Optimal management of resected gastric cancer. Cancer Manag Res. 2018;10:1605-1618.- doi: 10.2147/CMAR.S151552
» https://doi.org/10.2147/CMAR.S151552 -
15 Guideline Committee of the Korean Gastric Cancer Association (KGCA), Development Working Group & Review Panel. Korean Practice Guideline for Gastric Cancer 2018: an Evidence-based, Multi-disciplinary Approach. J Gastric Cancer. 2019;19(1):1-48. - doi: 10.5230/jgc.2019.19.e8
» https://doi.org/10.5230/jgc.2019.19.e8 -
16 van Hagen P, Hulshof MC, van Lanschot JJ, Steyerberg EW, van Berge Henegouwen MI, Wijnhoven BP, Richel DJ, Nieuwenhuijzen GA, Hospers GA, Bonenkamp JJ, Cuesta MA, Blaisse RJ, Busch OR, ten Kate FJ, Creemers GJ, Punt CJ, Plukker JT, Verheul HM, Spillenaar Bilgen EJ, van Dekken H, van der Sangen MJ, Rozema T, Biermann K, Beukema JC, Piet AH, van Rij CM, Reinders JG, Tilanus HW, van der Gaast A; CROSS Group. Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med. 2012;366(22):2074-2084.- doi: 10.1056/NEJMoa1112088.
» https://doi.org/10.1056/NEJMoa1112088 -
17 Jácome AA, Sankarankutty AK, Santos JS. Adjuvant therapy for gastric cancer: What have we learned since INT0116?. World J Gastroenterol. 2015;21(13): 3850-3859.- doi: 10.3748/wjg.v21.i13.3850
» https://doi.org/10.3748/wjg.v21.i13.3850 -
18 Japanese Gastric Cancer Association. Japanese classification of gastric carcinoma: 3rd English edition. Gastric Cancer. 2011;14(2):101-12.- doi: 10.1007/s10120-011-0041-5.
» https://doi.org/10.1007/s10120-011-0041-5 -
19 Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2010 (ver. 3). Gastric Cancer. 2011;14(2):113-23.- doi: 10.1007/s10120-011-0042-4.
» https://doi.org/10.1007/s10120-011-0042-4 -
20 Kim S, Lim DH, Lee J, Kang WK, MacDonald JS, Park CH, Park SH, Lee SH, Kim K, Park JO, Kim WS, Jung CW, Park YS, Im YH, Sohn TS, Noh JH, Heo JS, Kim YI, Park CK, Park K. An observational study suggesting clinical benefit for adjuvant postoperative chemoradiation in a population of over 500 cases after gastric resection with D2 nodal dissection for adenocarcinoma of the stomach. Int J Radiat Oncol Biol Phys. 2005;63(5):1279-85.- DOI:10.1016/j.ijrobp.2005.05.005
» https://doi.org/10.1016/j.ijrobp.2005.05.005 -
21 Macdonald JS, Smalley SR, Benedetti J, Hundahl SA, Estes NC, Stemmermann GN, Haller DG, Ajani JA, Gunderson LL, Jessup JM, Martenson JA. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med 2001;345:725-30.- DOI:10.1056/NEJMoa010187
» https://doi.org/10.1056/NEJMoa010187 - 22 Mogal H, Fields R, Maithel SK, Votanopoulos K. In Patients with Localized and Resectable Gastric Cancer, What is the Optimal Extent of Lymph Node Dissection-D1 Versus D2 Versus D3? Ann Surg Oncol. 2019 May 10. doi: 10.1245/s10434-019-07417-5. [Epub ahead of print]
- 23 Montenegro P, Flores L, Quintana S, Casanova L, Ruíz E, León J, Mantilla R. Adjuvant chemo radiotherapy after gastrectomy and D2 lymphadenectomy in patients with gastric cancer in the National Institute of Cancer, Lima, Peru. Rev Gastroenterol Peru. 2013;33(1):34-8.- PMID:23539054
-
24 Noh SH, Park SR, Yang H-K, et al. Adjuvant capecitabine plus oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): 5-year follow-up of an open-label, randomised phase 3 trial. Lancet Oncol. 2014;15(12):1389-1396.- doi: 10.1016/S1470-2045(14)70473-5.
» https://doi.org/10.1016/S1470-2045(14)70473-5 -
25 Norero E, Vargas C, Achurra P, Ceroni M, Mejia R, Martinez C, Muñoz R, Gonzalez P, Calvo A, Díaz A. Survival and perioperative morbidity of totally laparoscopic versus open gastrectomy for early gastric cancer: analysis from a single latin american centre. Arq Bras Cir Dig. 2019;32(1):e1413. doi: 10.1590/0102-672020180001e1413
» https://doi.org/10.1590/0102-672020180001e1413 -
26 Orditura M, Galizia G, Sforza V, Gambardella V, Fabozzi A, Laterza MM, Andreozzi F, Ventriglia J, Savastano B, Mabilia A, Lieto E, Ciardiello F, De Vita F. Treatment of gastric cancer. World J Gastroenterol. 2014;20(7):1635-1649.- doi: 10.3748/wjg.v20.i7.1635
» https://doi.org/10.3748/wjg.v20.i7.1635 -
27 Pacelli F, Papa V, Rosa F, Tortorelli AP, Sanchez AM, Covino M, Bossola M, Doglietto GB. Four Hundred Consecutive Total Gastrectomies for Gastric Cancer. A Single-Institution Experience. Arch Surg. 2008;143(8):769-75.- doi: 10.1001/archsurg.143.8.769
» https://doi.org/10.1001/archsurg.143.8.769 -
28 Park SH, Sohn TS, Lee J, Lim DH, Hong ME, Kim KM, Sohn I, Jung SH, Choi MG, Lee JH1, Bae JM, Kim S, Kim ST, Park JO, Park YS, Lim HY, Kang WK. Phase III trial to compare adjuvant chemotherapy with capecitabine and cisplatin versus concurrent chemoradiotherapy in gastric cancer: final report of the adjuvant chemoradiotherapy in stomach tumors trial, including survival and subset analyses. J Clin Oncol. 2015;33(28):3130-3136.- doi: 10.1200/JCO.2014.58.3930
» https://doi.org/10.1200/JCO.2014.58.3930 -
29 Norero E, Vargas C, Achurra P, Ceroni M, Mejia R, Martinez C, Muñoz R, Gonzalez P, Calvo A, Díaz A. Survival and perioperative morbidity of totally laparoscopic versus open gastrectomy for early gastric cancer: analysis from a single latin american centre. Arq Bras Cir Dig. 2019;32(1):e1413. doi: 10.1590/0102-672020180001e1413
» https://doi.org/10.1590/0102-672020180001e1413 -
30 Peng J, Wei Y, Zhou F, Dai J, Zhong Y, Xie C, Qin Y, Gong J, Xiong B, Zhou Y. D2-resected stage IIIc gastric cancer patients benefit from adjuvant chemoradiotherapy. Cancer Med. 2016;5(10):2773-2780.- doi: 10.1002/cam4.873.
» https://doi.org/10.1002/cam4.873 -
31 Pereira MA, Ramos MFKP, Dias A, Y OKi, Faraj SF, Zilberstein B, Cecconello I, Mello RS, Ribeiro-jr U. Detection of occult lymph node tumor cells in node-negative gastric cancer patients. ABCD Arq Bras Cir Dig. 2017;30(1):30-34.- doi: 10.1590/0102-6720201700010009
» https://doi.org/10.1590/0102-6720201700010009 -
32 Ramos MFKP, Pereira MA, Charruf AZ, Dias AR, Castria TB, Barchi LC, Ribeiro-Júnior U, Zilberstein B, Cecconello I. Conversion therapy for gastric cancer: expanding the treatment possibilities. Arq Bras Cir Dig. 2019;32(2):e1435. - doi: 10.1590/0102-672020190001e1435
» https://doi.org/10.1590/0102-672020190001e1435 -
33 Sasako M, Sakuramoto S, Katai H, Kinoshita T, Furukawa H, Yamaguchi T, Nashimoto A, Fujii M, Nakajima T, Ohashi Y. Five-year outcomes of a randomized phase III trial comparing adjuvant chemotherapy with S-1 versus surgery alone in stage II or III gastric cancer. J Clin Oncol. 2011;29(33):4387-4393.- doi: 10.1200/JCO.2011.36.5908
» https://doi.org/10.1200/JCO.2011.36.5908 -
34 SEER Cancer Statistics Review, 1992-2012 [database on the Internet]. National Cancer Institute. In 2015. Available from: [http://seer.cancer.gov/statfacts/html/stomach.html].
» http://seer.cancer.gov/statfacts/html/stomach.html -
35 Smalley SR, Benedetti JK, Haller DG, Hundahl SA, Estes NC, Ajani JA, Gunderson LL, Goldman B, Martenson JA, Jessup JM, Stemmermann GN, Blanke CD, Macdonald JS. Updated analysis of SWOG-directed intergroup study 0116: a phase III trial of adjuvant radiochemotherapy versus observation after curative gastric cancer resection. J Clin Oncol. 2012;30(19):2327-33.- doi: 10.1200/JCO.2011.36.7136
» https://doi.org/10.1200/JCO.2011.36.7136 -
36 Songun I, Putter H, Kranenbarg EM, Sasako M, van de Velde CJ. Surgical treatment of gastric cancer: 15-year follow-up results of the randomised nationwide Dutch D1D2 trial. Lancet Oncol. 2010;11(5):439-49.- doi: 10.1016/S1470-2045(10)70070-X
» https://doi.org/10.1016/S1470-2045(10)70070-X -
37 Stahl M, Walz MK, Stuschke M, Lehmann N, Meyer HJ, Riera-Knorrenschild J, Langer P, Engenhart-Cabillic R, Bitzer M, Königsrainer A, Budach W, Wilke H. Phase III comparison of preoperative chemotherapy compared with chemoradiotherapy in patients with locally advanced adenocarcinoma of the esophagogastric junction. J Clin Oncol. 2009;27(6):851-856.- doi: 10.1200/JCO.2008.17.0506
» https://doi.org/10.1200/JCO.2008.17.0506 -
38 Tsuburaya A, Yoshida K, Kobayashi M, Yoshino S, Takahashi M, Takiguchi N, Tanabe K, Takahashi N, Imamura H, Tatsumoto N1, Hara A, Nishikawa K, Fukushima R, Nozaki I, Kojima H, Miyashita Y, Oba K, Buyse M, Morita S, Sakamoto J. Sequential paclitaxel followed by tegafur and uracil (UFT) or S-1 versus UFT or S-1 monotherapy as adjuvant chemotherapy for T4a/b gastric cancer (SAMIT): a phase 3 factorial randomised controlled trial. Lancet Oncol. 2014;15(8):886-893.- doi: 10.1016/S1470-2045(14)70025-7
» https://doi.org/10.1016/S1470-2045(14)70025-7 -
39 Wang SY, Yeh CN, Lee HL, Liu YY, Chao TC, Hwang TL, Jan YY, Chen MF. Clinical impact of positive surgical margin status on gastric cancer patients undergoing gastrectomy. Ann Surg Oncol. 2009;16(10):2738-43. - doi: 10.1245/s10434-009-0616-0
» https://doi.org/10.1245/s10434-009-0616-0 -
40 Xu J, Zhu J, Wei Q. Adjuvant radiochemotherapy versus chemotherapy alone for gastric cancer: Implications for target definition. J Cancer. 2019;10(2):458-466.- doi: 10.1245/s10434-009-0616-0
» https://doi.org/10.1245/s10434-009-0616-0 - 41 Yakir R, Luna K, Marc W, Tamar S, Avraham R, Ayala H. The toxicity and outcomes of continuous 5-fluorouracil/cisplatin-based chemotherapy followed by chemoradiation in patients with resected high-risk gastric cancer: results of a single institute. Ann Acad Med Singapore. 2008;37(3):200-4.- PMID:18392298
-
42 Ychou M, Boige V, Pignon J-P, Conroy T, Bouché O, Lebreton G, Ducourtieux M, Bedenne L, Fabre JM, Saint-Aubert B, Genève J, Lasser P, Rougier P. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol. 2011;29(13):1715-1721.- doi: 10.1200/JCO.2010.33.0597
» https://doi.org/10.1200/JCO.2010.33.0597
Datas de Publicação
-
Publicação nesta coleção
20 Dez 2019 -
Data do Fascículo
2019
Histórico
-
Recebido
01 Jul 2019 -
Aceito
17 Set 2019

 A QUIMIORRADIOTERAPIA ADJUVANTES APÓS GASTRECTOMIA SUBTOTAL E TOTAL COM LINFADENECTOMIA D2 AUMENTAM A SOBREVIDA NO CÂNCER GÁSTRICO AVANÇADO?
A QUIMIORRADIOTERAPIA ADJUVANTES APÓS GASTRECTOMIA SUBTOTAL E TOTAL COM LINFADENECTOMIA D2 AUMENTAM A SOBREVIDA NO CÂNCER GÁSTRICO AVANÇADO?
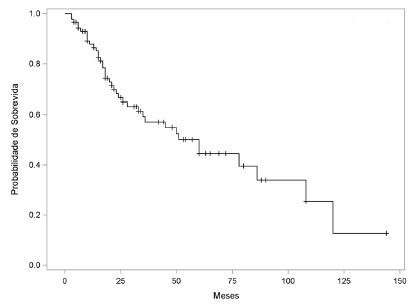 Média=65,99; mediana=60; DP=7,18
Média=65,99; mediana=60; DP=7,18
 Subtotal: média=76,47; mediana=86,00; DP=7,38. Total: média=27,34; mediana=18; DP=4,30
Subtotal: média=76,47; mediana=86,00; DP=7,38. Total: média=27,34; mediana=18; DP=4,30
 Sim: média=73,26; mediana=86; DP=8,46. Não: média=38,58; mediana=24; DP=5,67
Sim: média=73,26; mediana=86; DP=8,46. Não: média=38,58; mediana=24; DP=5,67
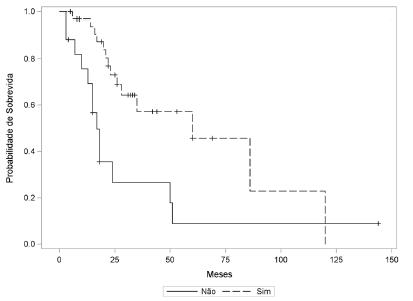 Sim: média-63,59; mediana=60. Não: média=31,73; mediana=17. Geral: média=54,63; mediana=35
Sim: média-63,59; mediana=60. Não: média=31,73; mediana=17. Geral: média=54,63; mediana=35